ПРОЦЕСС ПОЛУЧЕНИЯ АЦЕТИЛЕНА ТЕРМООКИСЛИТЕЛЬНЫМ ПИРОЛИЗОМ
1. Товарные и определяющие технологию свойства ацетилена
Ацетилен С2
Н2
обладает более высокой реакционной способностью, чем олефины. Он является одним из важнейших исходных соединений для синтеза большого числа разнообразных органических продуктов.
Ацетилен — бесцветный газ, обладающий в чистом виде слабым эфирным запахом; конденсируется при —83,8°С (0,102 МПа); критическая температура +35,5 °С; критическое давление 6,04 МПа. Он имеет очень широкие пределы взрываемости в смеси с воздухом [2,0—81 % (об.) С2
Н2
] и с кислородом [2,8—78 %(об.) С2
Н2
]. Взрывоопасность ацетилена усугубляется из-за высокой экзотермичности его разложения на простые вещества:
С2
Н2
→ 2С + Н2
 = 226,7 кДж/моль. = 226,7 кДж/моль.
Это разложение идет в отсутствие кислорода при наличии соответствующих инициаторов (искра, перегрев из-за трения). При давлении до 0,2 МПа разложение имеет местный характер и не является опасным. При более высоком давлении разложение приобретает характер взрыва с детонационной волной, распространяющейся со скоростью свыше 1000 м/с. Однако взрывоопасность ацетилена снижается при его разбавлении инертными газами или парами, которые аккумулируют тепло первичного разложения ацетилена и препятствуют его взрывному распаду. При этом максимальное безопасное давление смеси зависит от концентрации ацетилена (рис. 1). Взрывоопасность ацетилена сильно возрастает в присутствии металлов, способных к образованию ацетиленидов (например, Сu2
С2
), что надо иметь в виду при выборе конструкционных материалов.
Для предохранения от взрывов чаще всего ограничивают давление при производстве ацетилена и различных синтезах безопасными пределами—0,2
МПа.) При необходимости работы под давлением разбавляют ацетилен азотом, а иногда парами реагентов. При сжатии ацетилена применяют специальные ацетиленовые компрессоры, имеющие низкую скорость перемещения движущихся частей, малую степень сжатия и температуру газа после каждой ступени компрессора не более 100°С. При расчете аппаратуры и трубопроводов принимают повышенный запас прочности. Кроме того, применяют специальные предохранительные устройства, размещаемые в разных точках технологической схемы. Из них сухие затворы (в виде шарикового клапана) предохраняют только от распространения пламени. Мокрые огнепреградители и гидравлические затворы защищают предшествующую аппаратуру от распространения взрыва. Огнепреградитель представляет собой башню с насадкой, орошаемую водой, а гидравлическим затвором служит аппарат, в котором ацетилен барботирует через слой воды. Во всех случаях при превышении установленного давления сбрасывают газы в атмосферу через гидравлические затворы или предохранительные мембраны.
Забиваем Сайты В ТОП КУВАЛДОЙ - Уникальные возможности от SeoHammer
Каждая ссылка анализируется по трем пакетам оценки: SEO, Трафик и SMM.
SeoHammer делает продвижение сайта прозрачным и простым занятием.
Ссылки, вечные ссылки, статьи, упоминания, пресс-релизы - используйте по максимуму потенциал SeoHammer для продвижения вашего сайта.
Что умеет делать SeoHammer
— Продвижение в один клик, интеллектуальный подбор запросов, покупка самых лучших ссылок с высокой степенью качества у лучших бирж ссылок.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз,
а первые результаты появляются уже в течение первых 7 дней.
Зарегистрироваться и Начать продвижение
Другим технически важным свойством ацетилена является его растворимость, значительно более высокая, чем у других углеводородных газов. Так, в 1 объеме воды при 20 °С растворяется около 1 объема ацетилена, а при 60 °С растворяется 0,37 объема. Растворимость снижается в водных растворах солей и Са(ОН)2
. значительно выше растворимость ацетилена в органических жидкостях; при 20 °С и атмосферном давлении она составляет (в объемах ацетилена на 1 объем растворителя): в метаноле 11,2, в ацетоне 23, в диметилформамиде 32, N-метилпирролидоне 37. Растворимость ацетилена имеет важное значение при его получении и выделении из смесей с другими газами, а также в ацетиленовых баллонах, где для повышения их емкости по ацетилену и снижения давления используют растворитель (ацетон).
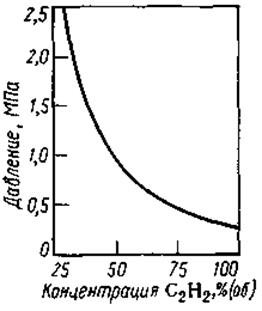
Рис 1
Зависимость максимально допустимого безопасного давления от концентрации ацетилена в смеси с азотом
2. Сырьевые источники получения ацетилена. Перспективы использования различного сырья
Карбид кальция получают из оксида кальция и кокса в электродуговых печах. Реакция сильно эндотермична и требует больших затрат электроэнергии, что составляет существенный элемент в себестоимости производимого ацетилена.
Исходным сырьем для получения ацетилена могут служить газообразные парафиновые углеводороды (метан, этан, пропан, бутаны) и жидкие нефтяные фракции, например прямогонные бензины.
Выбор углеводородного сырья зависит от многих факторов, в совокупности определяющих экономичность процесса в целом, от наличия ресурсов сырья, расхода энергии, выхода ацетилена и его концентрации в продуктах реакции, от количества и стоимости побочных продуктов и возможности их рентабельного использования.
Значительный интерес как источник сырья представляют дешевые нефтяные остатки. Установлено, что при пиролизе тяжелых углеводородов можно получать с высоким выходом ацетилен, концентрация которого в продуктах реакции достигает 31 – 33 %; кроме ацетилена, в них содержится 54 – 58 % водорода и 10 – 12 % олефинов, главным образом этилена. При переработке же газообразных углеводородов содержание ацетилена в продуктах реакции составляет от 7 до 16 %.
Сервис онлайн-записи на собственном Telegram-боте
Попробуйте сервис онлайн-записи VisitTime на основе вашего собственного Telegram-бота:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно.
Зарегистрироваться в сервисе
Однако промышленная технология переработки гудрона и других нефтяных остатков еще полностью не разработана, из-за чего это сырье пока не используется.
Энергетически наименее выгодным сырьем для получения ацетилена является метан. Для его пиролиза требуется затратить большее количество тепла (91 ккал/моль), в то время как для пиролиза этана и пропана требуется соответственно 78 и 61,9 ккал/моль. Пиролиз метана проводится при более высоких температурах, чем его гомологов. Однако метан используется для получения ацетилена на многих установках. Объясняется это тем, что метан – наиболее доступный и дешевый из углеводородов; он является основным компонентом природного газа, и последний может применяться для производства без разделения.
3.Современные промышленные способы получения ацетилена
Существуют два метода производства ацетилена: более старый – из карбида кальция и новый из углеводородов.
При разложении образовавшегося карбида кальция водой по экзотермической реакции получается ацетилен:
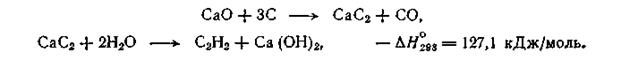
Из 1 кг технического карбида кальция, содержащего примеси кокса, оксида кальция и других веществ, получается 230—280 л ацетилена (эта величина называется литражом карбида). Теоретически из 1 кг чистого СаС2
должно образоваться 380 лС2
Н2
.
При разложении карбида кальция следует соблюдать некоторые условия для нормального протекания процесса. Реакция является гетерогенной, и ее скорость зависит от размера кусков карбида, особенно сильно возрастая при использовании карбидной мелочи и пыли. Реакционную массу необходимо перемешивать так как иначе на кусках карбида может образоваться слой извести, препятствующий полному разложению карбида и приводящий к местным перегревам. Из реакционной зоны нужно постоянно отводить тепло, чтобы предохранить ацетилен от возможной полимеризации и разложения.
По способу подвода тепла для проведения высокоэндотермичной реакции пиролиза углеводородов в ацетилен различают четыре метода.
1). Регенеративный пиролиз в печах с огнеупорной насадкой; ее сперва разогревают топочными газами, а затем через раскаленную насадку пропускают пиролизуемое сырье. Эти периоды чередуются.
2). Электрокрекинг при помощи вольтовой дуги, когда углеводородное сырье подвергают пиролизу в электродуговых печах при напряжении между электродами 1000 В. Затраты электроэнергии доходят до 13 000 кВт-ч на 1 т ацетилена, что составляет главный недостаток метода.
3). Гомогенный пиролиз, когда сырье вводят в поток горячего топочного газа, полученного сжиганием метана в кислороде и имеющего температуру 2000°С. Этот метод можно комбинировать с другими процессами пиролиза, если в горячие газы первой ступени пиролиза вводить пары жидких углеводородов, для расщепления которых в ацетилен требуется более низкая температура. Возможно и совместное получение ацетилена и этилена.
4). Окислительный пиролиз, при котором экзотермическая реакция горения углеводородов и эндотермический процесс пиролиза совмещены в одном аппарате.
Все эти способы пиролиза углеводородов на ацетилен применяют в промышленности, но наиболее экономичным из них является окислительный пиролиз.
4. Физико-химические основы процесса получения ацетилена методом термоокисленного пиролиза метана.
Из метана и других парафинов ацетилен получают путем высокотемпературного пиролиза по следующим обратимым реакциям:
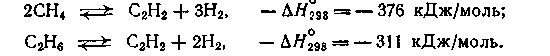
Эти реакции эндотермичны, и их равновесие смещается вправо только при 1000—1300°С. Однако при практическом осуществлении процесса с целью его ускорения требуется более высокая температура: 1500—1600°С для метана и 1200°С для жидких углеводородов.
Подобно пиролизу на олефины, реакции образования ацетилена имеют радикально-цепной механизм, причем цепь превращений метана и этана можно представить примерно так:
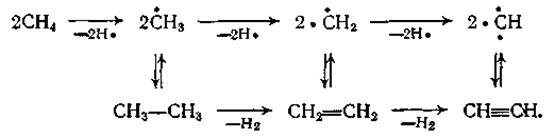
В полученном газе кроме низших парафинов и олефинов содержится небольшое количество бензола и ацетиленовых углеводородов — метилацетилена СН3
—С СН, а также винилацетилена СН2
=СН—С СН, а также винилацетилена СН2
=СН—С СН, диацетилена СН СН, диацетилена СН С—C С—C CH и др. CH и др.
Получение ацетилена данным методом осложняется побочной реакцией его разложения на углерод и водород. Она становится заметной при 1000°С и достигает значительной скорости при 1200—1600°С, т. е. при температуре, требуемой для получения ацетилена. В результате наблюдается система последовательных реакций, при которой образующийся ацетилен разлагается на водород и углерод (сажу):
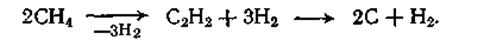
Как и в других подобных случаях, регулирование выхода промежуточного продукта может быть достигнуто уменьшением степени конверсии исходного углеводорода в результате снижения времени контакта. Найдено, что хороший выход ацетилена при небольшом образовании сажи можно получить при степени конверсии исходного углеводорода 50 % и времени его пребывания в зоне реакции 0,01 с. Во избежание дальнейшего разложения ацетилена необходима быстрая «закалка» реакционных газов (впрыскивание воды), при этом температура резко снижается до такой величины, при которой распада ацетилена не происходит.
При недостатке кислорода и высокой температуре сгорание метана происходит в основном по реакции:
СН4
+ О2
→ СО + Н2
+ Н2
О,  = 272,2 кДж/моль. = 272,2 кДж/моль.
Она протекает очень быстро, и образование ацетилена (как более медленный процесс) начинается лишь в зоне, практически лишенной кислорода. Там же происходит конверсия оксида углерода
СО + Н2
О ↔ СО2
+ Н2
,
причем соотношение водорода, оксидов углерода и водяных паров оказывается близким к этому равновесию водяного газа. В практических условиях около 1/3 кислорода расходуется на образование воды, 10—15 % на СО2
и 50—55 % на СО.
Поскольку процесс протекает в автотермическом режиме, для поддержания температуры  1500°С, необходимой для разложения метана, соотношение начальных объемов СН4
и О2
должно составлять 100:(60 1500°С, необходимой для разложения метана, соотношение начальных объемов СН4
и О2
должно составлять 100:(60 65), что находится вне пределов взрываемости этих смесей. Опасные концентрации могут возникнуть лишь во время смешения, проводимого при достаточно высокой скорости и турбулентности потока газов. Само горение метана характеризуется некоторым периодом индукции, длительность которого зависит от температуры и давления. Для метано-кислородных смесей указанного выше состава при атмосферном давлении и 600 °С период индукции составляет 65), что находится вне пределов взрываемости этих смесей. Опасные концентрации могут возникнуть лишь во время смешения, проводимого при достаточно высокой скорости и турбулентности потока газов. Само горение метана характеризуется некоторым периодом индукции, длительность которого зависит от температуры и давления. Для метано-кислородных смесей указанного выше состава при атмосферном давлении и 600 °С период индукции составляет  2с, что ограничивает время от смешения предварительно подогретых газов до их попадания в горелки, где происходит самовоспламенение смеси. Скорость течения газа в сопле горелки ( 2с, что ограничивает время от смешения предварительно подогретых газов до их попадания в горелки, где происходит самовоспламенение смеси. Скорость течения газа в сопле горелки ( 100 м/с) должна быть выше скорости распространения пламени, чтобы возникшее пламя не распространялось в обратном направлении. В то же время при стабильном режиме горения скорость газа не должна быть выше скорости гашения пламени, чтобы оно не отрывалось от горелки. При турбулентном потоке устойчивому горению способствуют подвод дополнительного количества кислорода в зону горения (так называемый стабилизирующий кислород), а также многосопловые устройства со множеством факелов горения, стабилизующих друг друга. 100 м/с) должна быть выше скорости распространения пламени, чтобы возникшее пламя не распространялось в обратном направлении. В то же время при стабильном режиме горения скорость газа не должна быть выше скорости гашения пламени, чтобы оно не отрывалось от горелки. При турбулентном потоке устойчивому горению способствуют подвод дополнительного количества кислорода в зону горения (так называемый стабилизирующий кислород), а также многосопловые устройства со множеством факелов горения, стабилизующих друг друга.
5. Аппаратурно-технологическая схема
Технологическая схема получения ацетилена окислительным пиролизом метана изображена на рис. 2. Кислород и метан подогревают до 600—700 °С в трубчатых печах 1
и 2,
имеющих топки для сжигания природного газа. В реакторе 3
протекают вышерассмотренные процессы, причем газы выходят из него после «закалки» водой при 80 °С и проходят для улавливания сажи полый водяной скруббер 4
и мокропленочный электрофильтр 5. Газы охлаждают водой в холодильнике 6
непосредственного смешения, после чего их промывают в форабсорбере 7
небольшим количеством диметилформамида или N-метилпирролидона и направляют в газгольдер 8.
Вода, стекающая из гидравлического затвора реактора и из сажеулавливающих аппаратов, содержит 2—3 % сажи, а также малолетучие ароматические соединения. Она поступает в отстойник 9,
с верха которого сажу и смолы собирают скребками и направляют на сжигание. Воду из отстойника возвращают в реактор как «закалочный агент», а ее избыток идет на очистку, чем создается замкнутая система водооборота без сбрасывания токсичных сточных вод.
Газ из газгольдера 8
сжимается компрессором 10
до давления  1 МПа, проходя после каждой ступени холодильники и сепараторы, не показанные на схеме. В абсорбере 11
он промывается диметилформамидом или N-метилпирролидоном, а непоглотившийся газ (Н2
, СН4
, СО, СО2
) проходит скруббер 12,
где при орошении водным конденсатом улавливается унесенный им растворитель. После этого газ можно использовать в качестве синтез-газа или топлива. 1 МПа, проходя после каждой ступени холодильники и сепараторы, не показанные на схеме. В абсорбере 11
он промывается диметилформамидом или N-метилпирролидоном, а непоглотившийся газ (Н2
, СН4
, СО, СО2
) проходит скруббер 12,
где при орошении водным конденсатом улавливается унесенный им растворитель. После этого газ можно использовать в качестве синтез-газа или топлива.
Раствор в кубе абсорбера 11
содержит ацетилен и его гомологи, а также значительное количество близкого к ним по растворимости диоксида углерода с примесью других газов. Он проходит дроссельный вентиль 13
и поступает в десорбер 14
первой ступени. За счет снижения давления до  0,15 МЦа и нагревания куба до 40 °С из раствора десорбируются ацетилен и менее растворимые газы. Ацетилен при своем движении вверх вытесняет из раствора диоксид углерода, который вместе с другими газами и частью ацетилена выходит с верха десорбера, предварительно отмываясь от растворителя водным конденсатом. Эти газы возвращают на компримирование. Концентрированный ацетилен выводят из средней части десорбера 14,
промывают в скруббере 15
водой и через огнепреградитель 16
выводят с установки. 0,15 МЦа и нагревания куба до 40 °С из раствора десорбируются ацетилен и менее растворимые газы. Ацетилен при своем движении вверх вытесняет из раствора диоксид углерода, который вместе с другими газами и частью ацетилена выходит с верха десорбера, предварительно отмываясь от растворителя водным конденсатом. Эти газы возвращают на компримирование. Концентрированный ацетилен выводят из средней части десорбера 14,
промывают в скруббере 15
водой и через огнепреградитель 16
выводят с установки.
Кубовую жидкость десорбера 14,
содержащую некоторое количество ацетилена и его гомологов, направляют в десорбер 18
второй ступени, подогревая предварительно в теплообменнике 17.
За счет нагревания куба до 100°С из раствора отгоняются все газы, причем из средней части колонны уходят гомологи ацетилена, направляемые затем на сжигание, а с верха — ацетилен с примесью его гомологов, возвращаемый в десорбер первой ступени. В растворителе постепенно накапливаются вода и полимеры, от которых его освобождают на установке регенерации, не изображенной на схеме. Полученный на установке концентрированный ацетилен содержит 99,0—99,5 % основного вещества с примесью метилацетилена, пропадиена и диоксида углерода (по 0,1—0,3%).
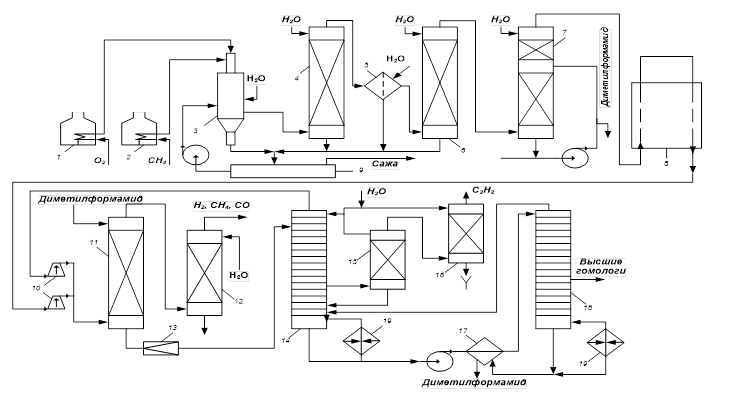
Рис. 2.
Технологическая схема получения ацетилена окислительным пиролизом метана:
1
, 2 —
трубчатые печи; 3 —реактор; 4 —
скруббер-сажеуловитель; 5
— электрофильтр; 6
— холодильник; 7 — форабсорбер; 8
— газгольдер; 9
— отстойник; 10
— компрессоры; 11
— абсорбер; 12, 15
— скрубберы; 13
— дроссельный вентиль; 14, 18
— десорберы; 16 —
огнепреградитель; 17
— теплообменник; 19 —
кипятильники;
6. Материальный баланс процесса пиролиза природного газа
при окислительном пиролизе протекают следующие реакции:
2СН4
↔С2
Н2
+Н2
– Q (1)
4СН4
+3О2
↔2С2
Н2
+6Н2
О+Q (2)
СН4
+О2
↔СО+Н2
+Н2
О+Q (3)
2СН4
+О2
↔2СО+4Н2
+Q (4)
Данные для расчета
1) Состав технического кислорода, % (об.):
кислород – 98,0;
азот - 1,0;
аргон - 1,0.
2) Число дней отводимых на ремонт – 15.
3) Состав природного газа, % (об.):
СН4
- 97,5;
С2
Н6
- 0,16;
СО2
- 0,50;
N2
- 1,80;
высшие углеводороды – 0,04.
4) Мощность установки по С2
Н2
, тыс.т/год 200;
5) Выход С2
Н2
на непрореагировавший метан, % 8,8;
6) Доля СН4
на реакцию (1) 0,72;
7) Распределение СН4
на реакции (3) : (4) 1 : 4.
Часовая производительность установки

Из реакций (1) и (2) следует, что 1 моль С2
Н2
получают из 2-х молей СН4
, т.е. расход метана на целевые реакции составит
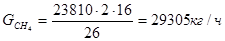
По заданию – выход ацетилена составляет 8,8% на метан, следовательно, количество поступившего на установку метана:
 ; ;
Состав газа в %(масс.):
Для пересчета объемного состава в массовый и обратно необходимо знать плотность r
i
каждого компонента:
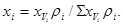
Масса любого газа при нормальных условиях равна его молярной массе, поделенной на объем, занимаемый одним молем, т.е.  , где , где  - плотность газа при нормальных условиях. - плотность газа при нормальных условиях.
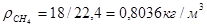
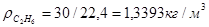
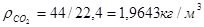
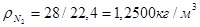
 ; ;
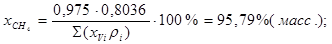
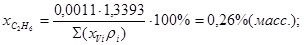
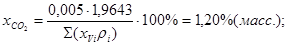
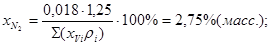
 ; ;
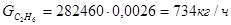
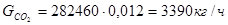
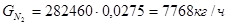
Исходя из того, что расход метана, идущего на целевые реакции 29305кг/ч, и доля метана на реакцию (1) составляет 0,72 расход метана на реакции составит:
(1)  ; ;
(2)  ; ;
Количество метана на реакции (3) и (4)
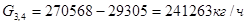
(3) 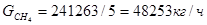
(4) 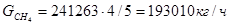
Материальный баланс процесса
По реакции (1)
Из 2 моль СН4
– 1моль С2
Н2
и 3 моль Н2
;
Для ацетилена –  ; ;  ; ;
Для водорода –  ; ;  . .
По реакции (2)
Из 4 моль СН4
и 3 моль О2
– 2 моль С2
Н2
и 6 моль Н2
О;
Для ацетилена -  ; ;  ; ;
Для воды - 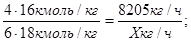  ; ;
Для кислорода - 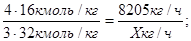  . .
По реакции (3)
Из 1 моль СН4
и 1 моль О2
– 1 моль СО, 1моль Н2
О и 1 моль Н2
;
Для окиси углерода –  ; ;  ; ;
Для воды –  ; ;  ; ;
Для водорода –  ; ;  ; ;
Для кислорода –  ; ; 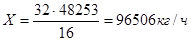
По реакции (4)
Из 2 моль СН4
и 1моль О2
– 2 моль СО и 4 моль Н2
;
Для окиси углерода –  ; ; ; ;
Для водорода –  ; ;  ; ;
Для кислорода –  ; ; 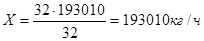
Расход кислорода (на технический кислород)
Расход чистого кислорода  12 308+96 506+193010=301824 кг/ч; 12 308+96 506+193010=301824 кг/ч;
Расход примесей:
 ; ;
 ; ;
 ; ;
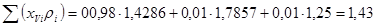
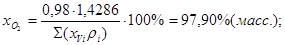
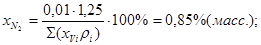
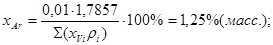
Gтехн.кисл.
Материальный баланс процесса пиролиза метана
| П Р И Х О Д |
| кг/ч |
%(масс.) |
Нм3
/ч |
%(об.) |
| Газ |
282460 |
47,81 |
176215 |
44,98 |
| В том числе: |
| метан |
270568 |
45,80 |
336695 |
85,95 |
| этан |
734 |
0,12 |
548 |
0,14 |
| двуокись углерода |
3390 |
0,57 |
1726 |
0,44 |
| азот |
7768 |
1,31 |
6214 |
1,59 |
| Кислород технический |
308298 |
52,19 |
215528 |
55,02 |
| В том числе: |
| кислород |
301824 |
51,09 |
211273 |
53,93 |
| азот |
2621 |
0,44 |
2097 |
0,54 |
| аргон |
3853 |
0,65 |
2158 |
0,55 |
| ИТОГО: |
590758 |
100,00 |
391743 |
100,00 |
| Р А С Х О Д |
| кг/ч |
%(масс.) |
Нм3
/ч |
%(об.) |
| ацетилен |
23810 |
4,03 |
20513 |
1,88 |
| Побочные продукты |
| окись углерода |
422211 |
71,47 |
337769 |
30,93 |
| водород |
58240 |
9,86 |
652288 |
59,73 |
| водяной пар |
68131 |
11,53 |
68131 |
6,24 |
| Транзитное |
| этан |
734 |
0,12 |
548 |
0,05 |
| двуокись углерода |
3390 |
0,57 |
1726 |
0,16 |
| азот |
10389 |
1,76 |
8311 |
0,76 |
| Примеси |
3853 |
0,65 |
2757 |
0,25 |
| ИТОГО: |
590758 |
99,99 |
1092043 |
100,00 |
Основные технологические показатели
Конверсия исходного сырья.
Количество метана и кислорода обозначаю Gз
, количество ацетилена – Gп
. Тогда конверсию сырья в процентах выражается следующим уравнением:
На метан 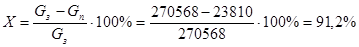
На кислород 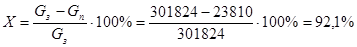
Селективность нахожу как отношение готового продукта Gп
к сырью Gc
(на метан)
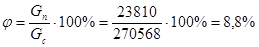
Выход целевого продукта.
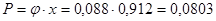
Расходные коэффициенты на получение 1 тонны продукта:
1. По метану стехиометрический коэффициент на 1 т ацетилена:
 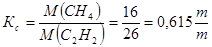
Расходный коэффициент с учетом селективности
Кр
= Кс
/ = 0,615 / 0,088= 6,99 т/т продукта. = 0,615 / 0,088= 6,99 т/т продукта.
2. По кислороду стехиометрический расходный коэффициент на 1 т ацетилена:
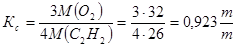
Расходный коэффициент с учетом селективности
Кр
= Кс
/ = 0,923 / 0,088 = 10,49 т/т продукта. = 0,923 / 0,088 = 10,49 т/т продукта.
ЛИТЕРАТУРА
1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
2. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
3. Общая химическая технология: Учеб. для химико-техн. спец. вузов. В 2-х т./под ред. проф. И.П.Мухленова. – М.: Высш. шк., 1984. – 263 с.
4. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. – М. Химия, 1988. – 592 с.
|